En 1937, W. L. Bragg publia une méthode de classification de toutes les sortes de silicates et de leurs structures cristallines basée sur le concept de la théorie ionique de L. Pauling. L’unité fondamentale est un complexe tétraédrique constitué de petits cations de Si4+, ou Al3+ en coordination tétraédrique avec quatre oxygènes (première règle de Pauling). De nombreux ouvrages universitaires expliquent la géométrie du tétraèdre SiO4- et autres structures minérales en relation avec la taille des différents ions.
Cette représentation en coordination ionique n’est plus du tout adaptée à la chimie des géopolymères qui est régie par les mécanismes de liaison covalente.
Non ionique (tétraèdre) mais covalent !
Dans la figure ci-dessous, six arrangements atomiques sont utilisés pour illustrer la structure silicate ionique (coordination avec les atomes d’oxygène) d’une part, et la construction covalente siloxonate/sialate d’autre part.
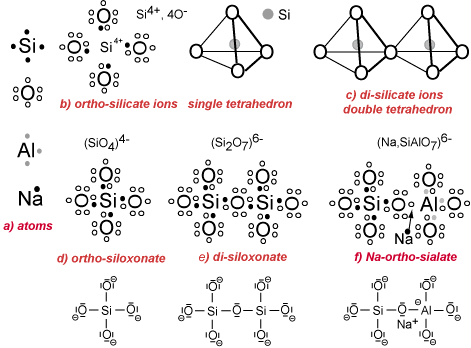
a) Distribution des électrons: dans les couches extérieures des atomes Si, O, Al et Na. Les règles d’électrovalence gouvernent la création de l’octet (8 électrons dans la coque extérieure) soit en donnant des électrons (donateur) ou en recevant des électrons (récepteur), comme suit:
– Si a 4 électrons. C’est un donateur ou un acceptateur (tetra-valence).
– O a 6 électrons. C’est un récepteur (di-valence).
– Al a 3 électrons. C’est un donateur en milieu acide (tri-valence) et un récepteur en solution alcaline (tetra-valence).
– Na a 1 électrons. C’est un donateur (mono-valence).
b) Concept ionique tétraèdre, coordination: Les ions (Si4+,4O–) forment le simple tétraèdre. Si donne 4 électrons aux 4 oxygènes et se transforme en petit cation Si4+. Le cation Si devient tetracoordonné avec les 4 anions d’O. Pour parfaire la stabilité anionique, chaque oxygène a besoin d’un huitième électron fournit par un métal (Na, K, Ca, Mg, Fe, etc.) ou un autre Si, non montré par la figure.
c) Concept ionique: En se partageant un anion commun d’un oxygène O2-, deux tétraèdres ou plus peuvent se lier pour former des groupes polyanioniques.
d) Concept de covalence: La molécule (SiO4) résulte du partage d’électrons entre un atome Si et ses quatre oxygènes environnant formant des liaisons covalentes Si-O. La molécules d’ortho-siloxonate (SiO4)4- requiert des donateurs d’ions métalliques supplémentaires (Na, K, Ca, Mg, Fe) non montrés dans la figure.
e) Concept de covalence: La polycondensation en di-siloxonate et en siloxonates plus polymérisés intervient par le partage supplémentaire d’électrons entre Si et O. La molécule de di-siloxonate (Si2O7)6- nécessite des ions métalliques donateurs additionnels (Na, K, Ca, Mg, Fe).
f) Concept de covalence: La formation de la molécule ortho-sialate avec la liaison covalente Si-O-Al- apparaît en milieu alcalin. L’atome d’Al prend l’électron unique appartenant à un métalloïde (par exemple Na) et devient tétra-valent, comme Si, avec une charge électrostatique négative supplémentaire. Le cation Na+ est fortement attaché à l’oxygène de la liaison sialate Si-O-Al et stabilise la charge négative.
Les différences entre le concept ionique de coordination et la liaison macromoléculaire covalente sont importantes. Le double tétraèdre dans la structure (c) partage un anion d’oxygène O2-, alors que dans la molécule de di-siloxonate de la structure (e), la liaison covalente est réalisée grâce à Si et O partageant un électron, aboutissant à une liaison covalente plus solide que la simple liaison ionique.
La géopolymérisation démarre avec les oligomères
Les synthèses géochimiques sont réalisées par les oligomères (dimère, trimère, tetramère, pentamère) qui fournissent les vraies unités structurales de l’édifice macromoléculaire tri-dimensionnel. Voir le livre de J. Davidovits Geopolymer Chemistry & Applications, aux chapitres 2, 5, 6, 7 et 8.
Exemple de géopolymérisation avec le métakaolin MK-750
Extrait du chapitre 8 du livre Geopolymer Chemistry & Applications:
Elle comporte 3 phases:
– dépolymérisation alcaline de la couche kaolinitique poly(siloxo) Si-O-Si-O-
– formation d’une molécule d’ortho-sialate (OH)3-Si-O-Al-(OH)3
– polymérisation (polycondensation) en oligomères ou polymères plus élevés.
Les cinétiques de géopolymérisation des Na-poly(sialate-siloxo) et K-poly(sialate-siloxo) sont quelques peu différentes. C’est probablement due aux différentes dimensions des cations Na+ et K+, K+ étant plus gros que Na+.
Mécanisme chimique sur l’Al(V) -Al=O alumoxyl (coordination Al V dans le métakaolin MK-750)
Le mécanisme chimique peut être interprété de la manière suivante, avec NaOH ou KOH (étapes 1 à 6-7):
Étape 1: alcalination et formation d’Al tétra-valent dans le groupement sialate latéral -Si-O-Al-(OH)3-Na+,
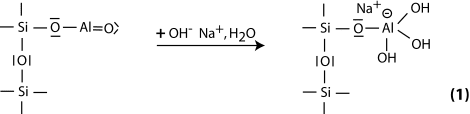
Étape 2: la dissolution alcaline démarre avec ajout d’un groupement OH- basique sur l’atome de silice qui est alors capable d’étendre sa sphère de valence vers un état penta-covalent,
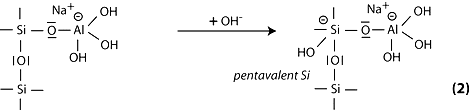
Étape 3: le parcours suivant de la réaction peut s’expliquer par le clivage de l’oxygène appartenant au groupe siloxane Si-O-Si et par le transfert d’électron de Si vers O, formation d’un silanol intermédiaire Si-OH d’une part, et du siloxo de base Si-O- d’autre part.
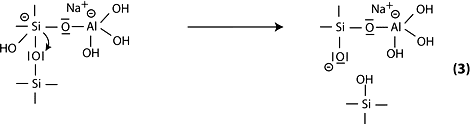
Étape 4: puis, formation des groupes silanol Si-OH et isolement de la molécule d’ortho-sialate, première unité réactive dans la géopolymèrisation.
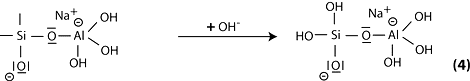
Étape 5: réaction du siloxo Si-O- basique avec le cation sodium Na+ et formation de la liaison terminale Si-O-Na.
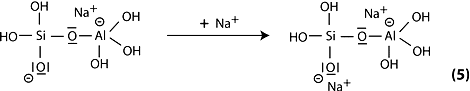
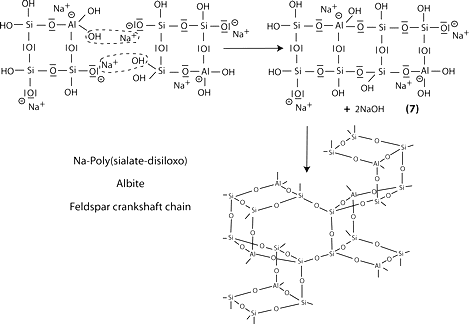
Étape 6a: condensation entre les molécules d’ortho-sialate, les groupes réactifs Si-ONa et hydroxyl d’aluminium OH-Al, avec production de NaOH, création de la structure cyclo-tri-sialate; l’alcali NaOH est libéré et réagit à nouveau. On aboutit à une polycondensation en réseau de type néphéline Na-poly(sialate).
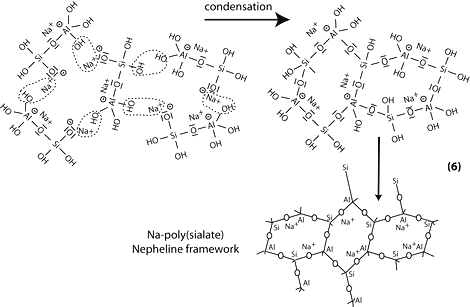
Étape 6b: en présence de silicate (Na- polysiloxonate soluble) on obtient une condensation entre les molécules de di-siloxonate Q1 et d’ortho-sialate, les groupes réactifs Si-ONa, Si-OH et hydroxyl aluminium OH-Al-, création d’une structure cyclique d’ortho-sialate-disiloxo, par où l’alcali NaOH est libéré et réagit une nouvelle fois.
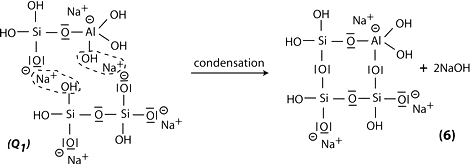
Étape 7: la polycondensation en réseau de type albite Na-poly(sialate-disiloxo) avec sa structure feldspath caractéristique de la chaine macromoléculaire en forme de vilebrequin.